La medicina di precisione è un modello che adatta il trattamento terapeutico alle caratteristiche individuali della malattia di un paziente: si tratta di un approccio di cura entusiasmante con moltissime opportunità per l’innovazione terapeutica. In questo contesto, i test diagnostici sono esemplificativi in quanto aiutano ad abbinare ad un paziente una terapia mirata e specifica.
Un test diagnostico è definito come un dispositivo medico in vitro in grado di identificare i pazienti “prima e/o durante il trattamento” con maggiori probabilità di beneficio clinico o con maggiori probabilità di rischio di gravi effetti collaterali a seguito del trattamento con un particolare farmaco.
Come viene sviluppato un test diagnostico? Quali sono i vantaggi e quali le sfide?
Questi test possono essere eseguiti su una biopsia tissutale o su un campione di sangue attraverso diverse tecnologie genomiche (ad esempio Next Generation Sequencing, qPCR) o basate su proteine (ad esempio immunoistochimica). Nel caso di un cancro, un test diagnostico può identificare se il tumore abbia una specifica anomalia genomica, come una mutazione o un’espressione alterata di una proteina, che è predittiva per una migliore efficacia della terapia.
I test diagnostici rappresentano uno strumento promettente per una medicina di precisione e personalizzata. La coppia ‘test-terapia’ rappresenta un valore per diversi stakeholder: medici, payers, enti regolatori, aziende farmaceutiche e di dispositivi medici, ma prima di tutto consentono al paziente di beneficiare della massima probabilità di risposta alla terapia.
Sviluppo dei test diagnostici
L’idea alla base del test diagnostico, frutto di anni di ricerca traslazionale e sviluppo clinico, consiste nel dimostrare la capacità di uno specifico biomarcatore di predire quali pazienti risponderanno meglio ad un candidato farmaco in studio.
Un test diagnostico è essenzialmente la trasformazione di un prototipo test molecolare, che ha dimostrato valore predittivo in termini di efficacia in early clinical trials, in un test validato e approvato dalle Autorità Sanitaria.
Esso viene sviluppato in parallelo alla terapia, attraverso la dimostrazione definitiva del beneficio clinico in un trial registrativo per uno specifico farmaco selezionato in una specifica indicazione di malattia.
Successivamente l’azienda farmaceutica invia una domanda di autorizzazione all’immissione in commercio per il farmaco e l’azienda produttrice del test presenta contemporaneamente una domanda per il dispositivo medico. Se viene concessa l’autorizzazione, l’utilizzo del test diagnostico è obbligatorio prima del trattamento con lo specifico farmaco approvato.
Patologie per le quali i test possono essere utilizzati
I test diagnostici aiutano i medici a trattare molti tipi di patologie. In alcuni tumori, i ricercatori sono stati in grado di individuare le mutazioni genetiche legate al loro sviluppo e di prevedere come i pazienti avrebbero risposto a una serie di terapie mirate.
Prendiamo come esempio HER2, una forma molto aggressiva di cancro al seno (12-20% di tutti i tumori al seno): quando il recettore HER2 è iper-prodotto causa una proliferazione incontrollata delle cellule tumorali. La biopsia tumorale mostrerà una sovra-espressione di questa proteina. Pertanto, i medici possono somministrare una terapia specifica anti-HER2. Il test diagnostico basato sul livello di espressione di HER2 deve essere eseguito prima del trattamento farmacologico specifico.
Le sfide da sviluppare: un test diagnostico complementare
La base dello sviluppo di un test diagnostico è costituita da solide evidenze scientifiche e cliniche che ne dimostrano il beneficio clinico e richiedono la collaborazione di diverse divisioni: medicina traslazionale, affari regolatori, medica e market access per garantire la scelta più appropriata di biomarcatore e tecnologia nonché il piano strategico di sviluppo e commercializzazione.
Le fasi chiave dello sviluppo di un test diagnostico sono sei, tutte sincronizzate con lo sviluppo del farmaco:
– Validazione scientifica
– Validazione analitica
– Dimostrazione dell’utilità clinica
– Autorizazione all’immissione in commercio
– Marketing&Post-Commercializzazione
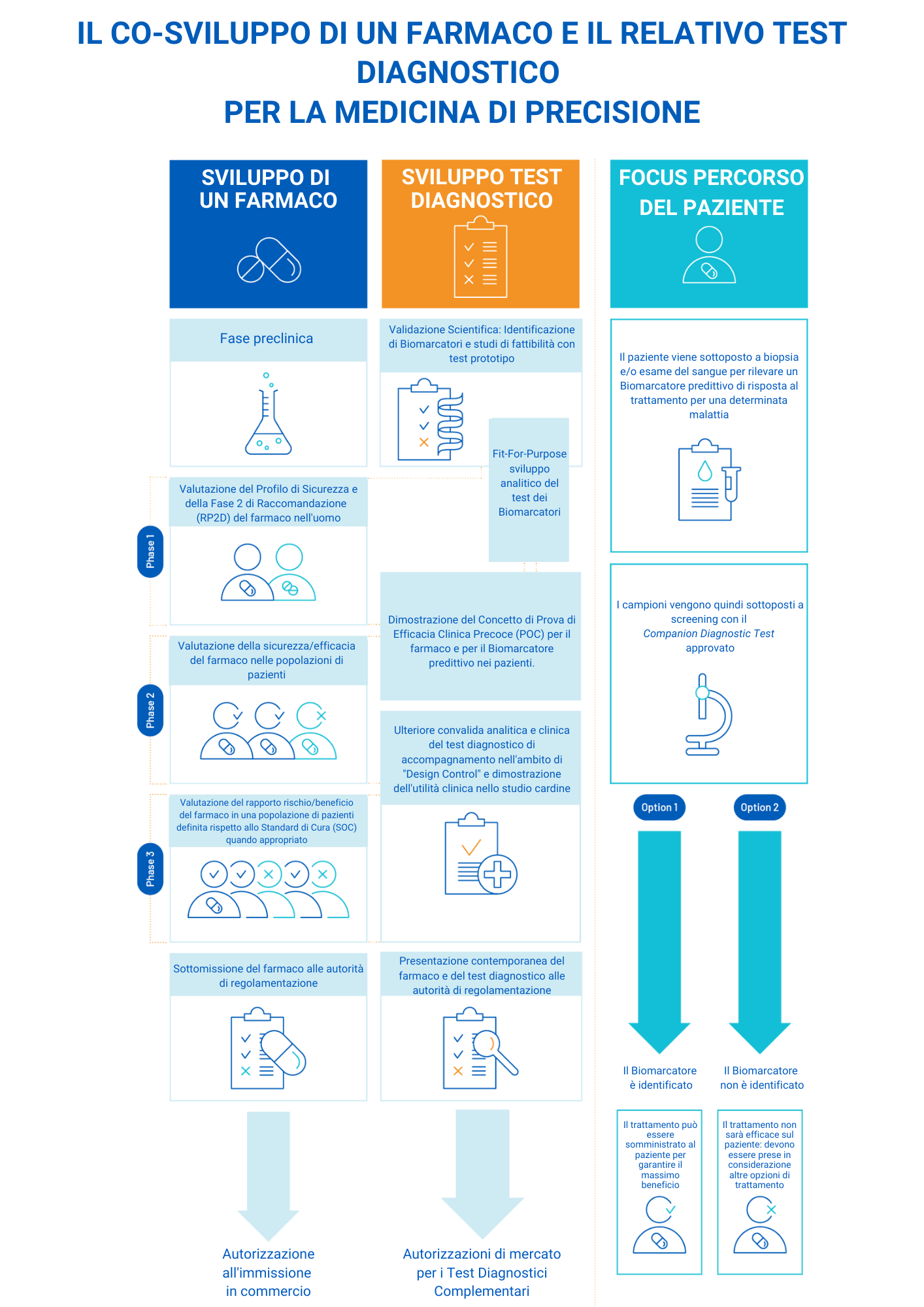
Lo sviluppo di questo tipo di test può richiedere fino a cinque anni e un costo approssimativo compreso tra 10 e 30 milioni di euro. In collaborazione con un produttore di test, l’azienda farmaceutica commercializza la terapia insieme al test. Le procedure regolatorie e di approvazione dei test diagnostici possono differire da paese a paese.
E Servier?
| Per soddisfare i crescenti bisogni di nuove soluzioni terapeutiche, Servier ha fatto dell’oncologia una delle sue priorità, alla quale dedica oltre il 50% del suo budget di ricerca e sviluppo. L’obiettivo del Gruppo è quello di guidare l’innovazione nella medicina di precisione ed essere in prima linea per fornire trattamenti in aree con elevati bisogni clinici insoddisfatti. Con un modello basato sul co-sviluppo di ‘test-farmaco complementari’, Servier sta entrando in una nuova era. La medicina di precisione permette di capire le cause di una malattia e di ridurre il tempo tra l’identificazione e le fasi di sviluppo clinico di una molecola. La stretta collaborazione tra ricercatori e medici aggiunge informazioni preziose e aumenta le probabilità di successo. I test diagnostici mirano ad accelerare il progresso della medicina personalizzata. Questo approccio si allinea perfettamente con la mission di Servier: fornire trattamenti innovativi e migliorare la qualità della vita dei pazienti lungo tutto il percorso di cura |



